Percorso Assistenziale Multidisciplinare
PER PAZIENTI AFFETTI DA DISTROFIA MUSCOLARE PROGRESSIVA Xp21 - TIPO DUCHENNE (DMD)
ASSOCIAZIONE ITALIANA DI MIOLOGIA (AIM)
Documento elaborato da: Tiziana Mongini (Univerità di Torino), Angela Berardinell (Università di Pavia, Sonia Messina (Università di Messina), Fabrizio Racca (Università di Torino), Luisa Politano (Università di Napoli) e Antonio Toscano (Università di Messina, Presidente AIM), con la collaborazione del Consiglio Direttivo dell’AIM
Indice
- Introduzione
- L’approccio multidisciplinare
- Aspetti motori
- Aspetti farmacologici
- Aspetti fisiatrici e riabilitativi
- Aspetti ortopedici
- Aspetti respiratori
- Aspetti cardiologici
- Aspetti della nutrizione e deglutizione
- Aspetti gastroentestinali e del linguaggio
- Aspetti psicosociali
- Aspetti di terapia del dolore
- Aspetti anestesiologici e di emergenza
- Il piano assistenziale globale
- Valutazione della richiesta assistenziale
- Bibliografia
Introduzione
 La Distrofia muscolare progressiva Xp21 (Distrofia muscolare di Duchenne - DMD; codice 310200 OMIM [Online Mendelian Inheritance in Man]) è una malattia geneticamente determinata, causata da mutazioni del gene della distrofina localizzato sul cromosoma X, in sede Xp21, trasmesse con carattere recessivo (1). L’incidenza della malattia è pari a 1 su 3600-6000 maschi nati vivi (2).
La Distrofia muscolare progressiva Xp21 (Distrofia muscolare di Duchenne - DMD; codice 310200 OMIM [Online Mendelian Inheritance in Man]) è una malattia geneticamente determinata, causata da mutazioni del gene della distrofina localizzato sul cromosoma X, in sede Xp21, trasmesse con carattere recessivo (1). L’incidenza della malattia è pari a 1 su 3600-6000 maschi nati vivi (2).
Le alterazioni genetiche sono rappresentate principalmente da delezioni, che comportano una alterata sintesi della proteina (assenza completa, riduzione qualitativa o quantitativa), con conseguente degenerazione progressiva del tessuto muscolare scheletrico in genere proporzionale al difetto proteico (3).
La malattia si manifesta prevalentemente con debolezza muscolare ad esordio variabile: nella forma più grave, con assenza completa di distrofina, i bambini presentano ritardo delle acquisizioni motorie, con maggior compromissione dei muscoli prossimali degli arti inferiori e conseguente difficoltà a correre, a rialzarsi da terra, a salire le scale; anche se minimi segni possono essere osservati già a 18-24 mesi. Purtroppo spesso la diagnosi viene fatta a 4-5 anni di età, quando le difficoltà motorie sono più evidenti. In qualche caso la diagnosi avviene più precocemente per il riscontro di occasionale di elevati livelli di transaminasi (AST, ALT) o di creatin kinasi (CK) nel corso di accertamenti routinari.
Se non trattata, la malattia progredisce coinvolgendo sistematicamente la muscolatura, con conseguente perdita della deambulazione intorno ai 12 anni, molto spesso associata a scoliosi, retrazioni e blocchi articolari diffusi, comparsa di insufficienza respiratoria, complicazioni cardiache, complicazioni gastroenterologiche e, talora, disfunzioni cognitive di grado variabile.
Nelle sue forme varianti più benigne, la Distrofia Muscolare Xp21 può manifestarsi con un fenotipo intermedio (perdita della deambulazione tra i 13 e i 16 anni) o benigno (distrofia muscolare di Becker – DMB) con deambulazione conservata oltre i 16 anni o addirittura fino alla sesta decade. Alcuni casi possono manifestarsi solo con il rialzo isolato della creatin kinasi (CK) o con una cardiomiopatia isolata. Le donne portatrici della mutazione sono solitamente asintomatiche e possono presentare un rialzo della CK, ma nel 10% circa dei casi sono presenti segni clinici lievi della malattia; nei rari casi di inattivazione sbilanciata del cromosoma X o di riarrangiamenti cromosomici la malattia può manifestarsi con la forma più grave anche nelle bambine.
Se gli interventi assistenziali, mirati soprattutto alla prevenzione delle complicazioni e al supporto ventilatorio, vengono organizzati in modo ottimale, la storia naturale della malattia può essere significativamente modificata, permettendo il raggiungimento di risultati significativi in ambito di sopravvivenza, obiettivi educativi e lavorativi, e un miglioramento della qualità di vita in genere. Attualmente l’aspettativa di vita di un giovane con DMD è più che raddoppiata rispetto a qualche anno fa, e ormai la maggior parte dei pazienti può raggiungere la quarta-quinta decade di vita (4).
Pertanto l’organizzazione di un percorso assistenziale di tipo multidisciplinare è indispensabile per questa malattia, così come per le altre forme di distrofia muscolare causate da mutazioni di proteine appartenenti o correlate al complesso della distrofina, che causano fenotipi identici per presentazione clinica e evoluzione. per presentazione clinica e evoluzione quali, ad es. calpainopatie, disferlinopatie, sarcoglicanopatie e altre ancora.
Per tali motivi, raccomandazioni in tal senso sono state suggerite da varie organizzazioni a livello mondiale, in particolare da gruppi di studio multidisciplinari di clinici e ricercatori (TREAT-NMD) e dalle Associazioni Pazienti (MDA, Parent Project). Negli Stati Uniti nel 2001 è stato promulgato il “Muscular Dystrophy Community Assistance, Research, and Education Amendments”, contenente le direttive per la ricerca e le iniziative di sanità pubblica per le distrofie muscolari. In Europa nel 2006 è stata creata una rete collaborativa di eccellenza, il TREAT-NMD (supportata da fondi dell’Unione Europea - EC036825), che si occupa attivamente di organizzare incontri tra ricercatori, clinici e pazienti per l’ottimizzazione delle risorse da dedicare alle malattie neuromuscolari. In particolare, sono state recentemente pubblicate le linee guida per la diagnosi e il trattamento della DMD (4,5). Nel 2000 in Italia è nata l’Associazione Italiana di Miologia, una società scientifica autonoma cui afferisce la maggior parte dei Centri che diagnosticano le malattie neuromuscolari ed effettuano la presa in carico delle persone con le suddette patologie, sia di età pediatrica che adulta.
Nell’ambito dell’AIM, sono nati vari gruppi di ricerca che collaborano tra loro in Italia, che si sono inizialmente avvalsi del supporto di Telethon o di altre Fondazioni o Associazioni di Pazienti, grazie ai quali è stato possibile iniziare un lavoro comune per la condivisione dei protocolli clinici. In particolare, per la DMD, è un attivo un gruppo di lavoro che, tra l’altro, ha provveduto ad un addestramento comune ed omogeneo per la somministrazione delle scale per la valutazione funzionale in ogni Centro partecipante.
L’AIM ha recentemente condotto un ampio censimento dei vari Centri ad essa afferenti evidenziando la presenza di un notevole numero di strutture con specifiche competenze in ambito di ricerca, assistenza e presa in carico dei pazienti con Malattie Muscolari. Il censimento AIM ha rivelato l’esistenza di strutture dedicate soltanto alla diagnostica o solo alla presa in carico dei pazienti post-diagnosi ma anche di strutture in grado di svolgere entrambe le attività.
Tuttavia sono state evidenziate notevoli problematiche di tipo organizzativo pratico, rappresentate prevalentemente da carenze strutturali e di personale, e da disuguaglianze di disponibilità di risorse territoriali.
Approccio multidisciplinare
Poiché la maggior parte delle malattie muscolari è caratterizzata da un interessamento multisistemico, l’approccio multidisciplinare rappresenta la modalità assistenziale più idonea per queste malattie, in particolare per quelle con esordio in età infantile e decorso progressivo nel tempo e con lunga sopravvivenza. Come per altre malattie neuromuscolari (es., la SLA), questo approccio è condiviso a livello internazionale (4,5).
Il ruolo di coordinatore delle cure o coordinatore assistenziale (Care Manager) può essere meglio assunto, secondo la disponibilità delle strutture sanitarie nell’area di residenza e dell’età del paziente, da un neurologo/neuropsichiatra infantile, da uno specialista della riabilitazione, da uno pneumologo, o da un medico di base (pediatra o medico di famiglia per gli adulti), purché specificamente formati. Il compito è quello di controllare periodicamente lo stadio di evoluzione della malattia attraverso strumenti e modalità di valutazione standardizzati, e di predisporre le adeguate misure preventive e le terapie del caso.
Il tipo di controlli può variare secondo l’età e l’evoluzione individuale della malattia, come successivamente indicato. A tal proposito è indispensabile l’individuazione o creazione di Centri dedicati (Centri multidisciplinari dedicati - Centri di Riferimento, CdR) nei quali sia disponibile un gruppo di lavoro formato da diversi specialisti, costituito per garantire una presa in carico globale del paziente con DMD o altre patologie affini.
Anche in relazione alle indicazioni delle recenti linee guida del TREAT-NMD, oltre al neurologo o neuropsichiatra infantile, le figure professionali necessarie per la definizione dei Centri dedicati sono le seguenti: specialista della riabilitazione, pneumologo, cardiologo, dietologo, ortopedico, endocrinologo/auxologo, terapista motorio, terapista respiratorio, dietista, logopedista, terapista occupazionale, psicologo ed assistente sociale.
In considerazione della realtà esistente in Italia, si può auspicare la presenza di due tipologie di CdR:
1) CdR di primo livello
- attuano la presa in carico di pazienti a livello ambulatoriale, e/o in regime di ricovero o di assistenza domiciliare
- coordinano la attività delle differenti figure professionali, attraverso una programmazione dei vari interventi che vengono effettuati presso sedi direttamente correlate, ma site in altro luogo del territorio di competenza.
- erogano interventi di riabilitazione finalizzati a:
- elaborare o completare il Piano Riabilitativo Individuale avviato precedentemente per favorire il recupero o la stabilizzazione del massimo livello funzionale possibile.
- inquadrare i soggetti dal punto di vista diagnostico funzionale con valutazioni anche domiciliari e aggiornare il PRI.
- favorire il reinserimento del soggetto nel proprio domicilio.
2) CdR di secondo livello
- devono essere ubicati all’interno di un presidio ospedaliero dove siano presenti le competenze specialistiche di supporto alla gestione della complessità della patologia.
- devono avere un’area intensiva e sub-intensiva ad alta valenza internistica e riabilitativa;
- devono erogare interventi ad alta complessità assistenziale e riabilitativa in regime di degenza ordinaria, Day Hospital e ambulatoriale
- prevedono la presenza in sede di tutte le figure professionali necessarie (vedi sopra)
Version:1.0 StartHTML:0000000250 EndHTML:0000239738 StartFragment:0000063267 EndFragment:0000239702 SourceURL:file://localhost/Users/cmazzuc/Documents/Dati%20utente%20Microsoft/Allegati%20salvati/Percorso%20assistenziale%20DMD%20+%20autori.doc
E’ opportuno che i CdR garantiscano integrazione fra di loro e unitarietà e globalità di intervento rispetto alle esigenze della persona con DMD svolgendo un percorso personalizzato ed assicurando continuità della presa in carico dalle fasi di ricovero, integrazione e supporto ai servizi territoriali.
In funzione delle diverse aree dei bisogni (motricità, terapia farmacologica, trattamento fisiatrico, trattamento ortopedico, respirazione, cuore, nutrizione e problematiche gastroenterologiche, aspetti psicosociali, anestesiologici), la gestione dei sintomi della persona affetta da DMD o da distrofie muscolari affini dovrà seguire una serie di indicazioni che abbiamo qui di seguito sintetizzato.
1. ASPETTI MOTORI
La valutazione dell’attività motoria è parte fondamentale dell’esame clinico della DMD nelle sue varie tappe evolutive, e deve essere condotta da uno specialista esperto in malattie neuromuscolari.
Il coinvolgimento e la perdita progressiva di funzione dei vari distretti muscolari scheletrici può condurre inizialmente ad una limitazione, quindi alla progressiva perdita dell’autonomia personale e al modificarsi dello stile di vita, in maniera variabile riguardo le varie fasce di età. Tutto ciò esige, come è evidente, un monitoraggio attento e costante delle capacità motorie residue e l’attuazione di tutte le strategie atte alla migliore utilizzazione delle stesse.
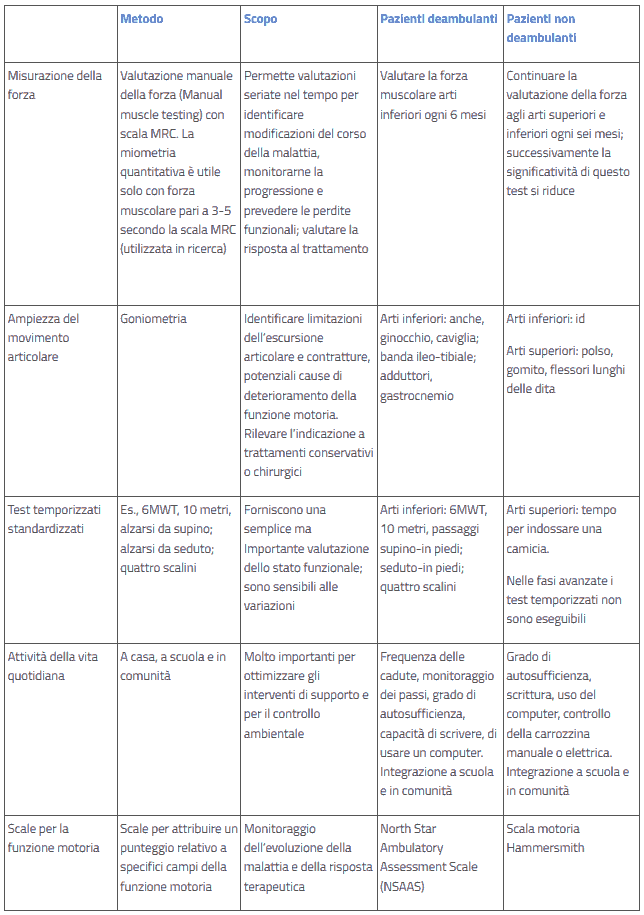
Tale valutazione va effettuata attraverso l’utilizzo di scale appositamente ideate e somministrate da personale esperto e appositamente istruito (neurologo o neuropsichiatra infantile, fisiatra, fisioterapista), che valutino forza muscolare, raggio di mobilità articolare , postura, deambulazione e funzione motoria con test temporizzati capacità di effettuare le attività della vita quotidiana e l’autonomia (6,7).
Tutte queste valutazioni appaiono fondamentali in relazione alla tempistica delle misure terapeutiche.
La Tabella 1 riassume le differenti modalità di valutazione secondo le fasce di età (da Bushby et al (4), modificata)
La valutazione dei deficit motori consentirà l’adeguata formulazione del Progetto Assistenziale Individuale (PAI) che, a livello del territorio attraverso la Funzione Distrettuale di Care Manager, deve provvedere all’attivazione dei trattamenti motori e alla fornitura degli ausili necessari.
A tal proposito è necessario costituire un canale diretto di comunicazione tra CdR dedicato e Funzione Distrettuale di Care Manager per velocizzare i tempi di fornitura dell’ausilio stesso.
In alcune Regioni è attivo in via sperimentale l’utilizzo di un Portale on-line che mette in diretta comunicazione il Centro prescrittore con il territorio. Tuttavia risulta imprescindibile, per quanto concerne la protesica, l’approvazione del nuovo Nomenclatore tariffario in modo che sia garantita la fornitura adeguata ad ogni persona con disabilità, secondo lo schema del D.P.C.M. sui nuovi LEA.
2. ASPETTI FARMACOLOGICI
E’ stato dimostrato che la terapia farmacologica, e in particolare la terapia steroidea se associata alla terapia preventiva fisiatrica, riesce a modificare la storia naturale della malattia, come ampiamente osservato negli ultimi quindici anni.
Infatti è stato dimostrato un rallentamento della perdita di forza muscolare, un prolungamento del tempo di deambulazione autonoma, una riduzione del rischio di scoliosi e una stabilizzazione della funzione respiratoria (8). Pertanto, la terapia steroidea è raccomandata dalle Linee guida attualmente disponibili (4). Non esiste però ancora un consenso unanime sul tipo di steroide (prednisone, prednisolone o deflazacort a dosaggi vari), sull’età di inizio o di eventuale sospensione e sul regime di trattamento (somministrazione quotidiana o a giorni alterni).
Uno studio multicentrico internazionale (FOR-DMD, coordinato da NIH e TREAT-NMD) mirato al confronto di tre differenti regimi con due tipi di steroidi orali è appena iniziato e potrà rispondere a questi quesiti entro qualche anno (9). In linea generale, si raccomanda di non iniziare la terapia steroidea nei bambini che stanno ancora progredendo nelle acquisizioni motorie (in genere fino ai 4-6 anni), e di essere cauti con chi ha seri rischi di effetti collaterali (disturbi comportamentali, fratture, obesità).
Si ritiene che prednisone e deflazacort abbiano simili profili di efficacia (4), per cui la scelta dipende prevalentemente dalla possibilità di effetti collaterali indesiderati (eccessivo aumento di peso, iperattività, rallentamento della crescita) che secondo alcuni studi sono minori con il deflazacort. Il regime quotidiano sembra preferibile a quello a giorni alterni, ma quest’ultimo è maggiormente indicato in caso di comparsa di effetti collaterali. Indipendentemente dal tipo di farmaco e dal regime scelto, l’inizio della terapia con steroidi comporta la programmazione di controlli seriati (una volta al mese all’inizio della terapia, poi ogni tre mesi) dei parametri vitali di base (temperatura, pressione arteriosa, peso corporeo e altezza) e del test del glucosio su urina.
Vanno inoltre programmati annualmente il dosaggio sierico di 25H-vitamina D, una densitometria ossea ed una visita oculistica per ricerca di eventuale cataratta. La maggior parte dei clinici esperti consiglia la prosecuzione della terapia steroidea anche dopo la perdita della deambulazione, anche se non vi sono studi specifici a favore.
3. ASPETTI FISIATRICI E RIABILITATIVI
Il trattamento riabilitativo è parte fondamentale dell’approccio assistenziale multidisciplinare e ha permesso di raggiungere importanti risultati quando attuato in modo corretto e in ambiente esperto. Il documento (All. 3) del Gruppo Monotematico per la Riabilitazione riassume i principi generali di trattamento e quelli organizzativi di base per le malattie neuromuscolari in genere. In questo capitolo vengono descritti più in dettaglio le necessità specifiche per la DMD.
Retrazioni
Nella DMD una minore flessibilità muscolare e le retrazioni articolari sono causati di diversi fattori, tra cui la limitazione dei movimenti articolari attivi completi, la postura con atteggiamento in flessione, lo squilibrio tra muscoli agonisti ed antagonisti che agiscono sull’articolazione e la sostituzione del tessuto muscolare con tessuto fibrotico.
Il mantenimento del movimento per tutta l’escursione articolare e della simmetria tra i due lati sono importanti per permettere un movimento ottimale ed una postura funzionalmente utile, per mantenere la deambulazione e prevenire lo sviluppo di deformità e mantenere l’integrità della cute (5).
La gestione delle retrazioni articolari richiede l’intervento dello specialista in malattie neuromuscolari, del fisiatra, del fisioterapista e del chirurgo ortopedico (10). I programmi riabilitativi per prevenire le retrazioni possono essere effettuati nel quotidiano dai genitori adeguatamente addestrati e dal terapista del centro riabilitativo sul territorio, e monitorati ed implementati dal fisioterapista del CdR, che li può adattare ai bisogni del paziente, allo stadio di malattia, alla risposta alla terapia e alla tolleranza agli esercizi, con controlli ogni tre-quattro mesi (5).
Soprattutto nelle fasi precoci di malattia, gli esercizi di stretching al tendine d’Achille possono essere effettuati dai genitori, senza sottoporre il bimbo ad un regime di fisioterapia strutturato.
Uno stretching efficace dell’unità muscolotendinea richiede una combinazione di interventi che includono stretching attivo, stretching attivo-assistito, stretching passivo ed allungamenti prolungati mediante posizionamento, utilizzo di doccette notturne, ortesi e strumenti per il mantenimento della stazione eretta. Quando lo stare in piedi e la deambulazione divengono più difficoltosi devono essere raccomandati programmi specifici per il mantenimento della stazione eretta.
Recentemente l’utilizzo dei gessi seriali ha mostrato una notevole efficacia nel correggere le retrazioni a livello dei tendini d’Achille. Questo approccio viene solitamente effettuato mediante tre applicazioni a distanza di circa cinque giorni di bende gessate che progressivamente correggono le retrazioni presenti. Esso presenta notevoli vantaggi rispetto all’approccio chirurgico essendo non invasivo, non doloroso e non limitando la normale vita di relazione del paziente (11).
Gli esercizi di stretching attivo, attivo-assistito e passivo per prevenire o minimizzare le retrazioni per ogni articolazione e distretto muscolare dovrebbero essere effettuati almeno 4 giorni a settimana. Gli esercizi di stretching dovrebbero essere effettuati a casa e/o presso il centro riabilitativo a seconda delle esigenze della famiglia. Durante entrambe le fasi, deambulatoria e non, sono necessari regolari esercizi di stretching alle caviglie, ginocchia ed anche. Durante la fase non deambulatoria, l’attenzione del programma riabilitativo andrà focalizzata soprattutto su esercizi regolari di stretching alle estremità degli arti superiori, che includono i muscoli flessori lunghi delle dita, il polso, il gomito e l’articolazione della spalla. In particolare il mantenimento di una buona mobilità di mano e polso deve essere preservata per permettere ai pazienti di mantenere più a lungo possibile un corretto utilizzo del joy-stick della carrozzina.
Ortesi
La prevenzione delle retrazioni si attua anche mediante l’utilizzo di tutori, di un corretto posizionamento delle articolazioni e di programmi per il mantenimento della stazione eretta. I tutori gamba-piede (AFOs: ankle foot orthoses) indossati durante la notte possono aiutare a prevenire o a ridurre la progressione delle retrazioni in equinismo e andrebbero utilizzati fino alle fasi più precoci di malattia. Gli AFOs dovrebbero essere modellati mediante calco in modo da creare una correzione confortevole ed ottimale dell’angolo tra caviglia e piede. I tutori ginocchio-caviglia-piede (KAFOs: knee ankle foot orthoses) per la prevenzione di retrazioni e deformità possono essere di aiuto nell’ultimo periodo di deambulazione e nelle prime fasi dopo la perdita della deambulazione autonoma per permettere il mantenimento della posizione eretta ed una limitata deambulazione (5). L’utilizzo dei tutori AFOs durante il giorno può essere indicato nei soggetti che usano la carrozzina tutto il giorno. Gli AFOs non sono indicati durante la deambulazione perchè tendono tipicamente a limitare i movimenti compensatori, aggiungono peso e possono rendere più difficile l’alzarsi da terra. Durante l’ultima fase di deambulazione, l’utilizzo dei KAFOs con un blocco all’altezza del ginocchio può prolungare la capacità di deambulare.
Tutori da riposo per le mani sono indicati per i pazienti con retrazioni ai muscoli flessori lunghi delle dita. Durante l’ultima fase di deambulazione, sarà necessario l’utilizzo di una carrozzina manuale ultra leggera con supporto alla seduta ed allo schienale, che permetterà di rispettare la simmetria della schiena e di mantenere una corretta posizione degli arti inferiori e potrà essere utilizzata per compiere lunghi tragitti. Nelle prime fasi dopo la perdita della deambulazione, una carrozzina manuale con seduta modellata e possibilità di essere reclinata potrebbe servire in sostituzione della carrozzina elettrica.
Con il progressivo declino nella deambulazione, una carrozzina elettrica è necessaria. E’ utile l’uso di sedute personalizzate e componenti aggiuntivi per migliorare la postura, che includono poggiatesta, rinforzi per la seduta e lo schienale, supporti laterali per il tronco, sistema reclinabile elettrico, regolazione elettrica dell’altezza della seduta, poggia piedi elettrico regolabile. Nel momento in cui la forza agli arti superiori declina, è necessario il ricorso ad uno specialista dei presidi tecnologici di assistenza, per la valutazione di adattamenti per il computer e per il joy-stick, come il sistema di controllo con tocco della lingua o il puntatore ad infrarossi (12).
Altri adeguamenti nelle ultime fasi della deambulazione e in quelle di non deambulazione potrebbero includere un letto reclinabile elettrico con materasso e cuscino antidecubito, adeguamenti alla stanza da bagno ed alla vasca ed ausili per lo spostamento, quali ad esempio i sollevatori.
Ausili per il mantenimento della stazione eretta
L’uso di ausili per il mantenimento passivo della stazione eretta per i pazienti senza o con lievi retrazioni all’anca, al ginocchio o alle caviglie è necessario nelle ultime fasi della deambulazione e nelle prime fasi dopo la sua perdita. Molti sostengono l’opportunità di usare tali ausili o carrozzine elettroniche in grado di porre il paziente in posizione eretta anche durante le fasi tardive di malattia se le contratture non sono così severe da limitare il posizionamento e se vengono ben tollerati.
4. ASPETTI ORTOPEDICI
Retrazioni
Sebbene l’utilizzo di un corretto approccio preventivo mediante esercizi di stretching o con ausili mirati abbia reso meno frequente la necessità di un trattamento chirurgico, vi sono alcuni casi nei quali la chirurgia deve essere ancora tenuta in considerazione (5). In questi casi l’approccio deve essere strettamente personalizzato.
Le articolazioni che più frequentemente necessitano di correzione chirurgica, anche dopo l’utilizzo di tutori, sono le caviglie e, in minor misura le ginocchia. A livello delle anche, gli interventi chirurgici per le retrazioni in flessione non hanno dato finora risultati particolarmente incoraggianti, in quanto gli interventi di allungamento del muscolo ileopsoas o di altri muscoli flessori dell’anca, può portare ad un ulteriore indebolimento e rendere il paziente incapace di deambulare.
Nei pazienti deambulanti, le deformità dell’anca spesso si correggono da sole se le ginocchia e le caviglie vengono poste in posizione corretta, perché la flessione dell’anca e la lordosi lombare potrebbero agire come meccanismi di compenso. Varie opzioni chirurgiche sono disponibili e la scelta dipenderà dalle circostanze individuali e possono essere indicate sia nella fase della deambulazione sia dopo.
Fase iniziale di deambulazione
Le procedure di correzione delle retrazioni in fase precoce includono l’allungamento del tendine d’Achille per le retrazioni in equinismo, l’allungamento del tendine del ginocchio per le retrazioni in flessione, il rilasciamento dei muscoli anteriori dell’anca per le retrazioni in flessione, ed anche l’incisione della benderella ileo-tibiale per le retrazioni in abduzione dell’anca, tecnica a volte effettuata anche in pazienti giovani(13).
Un altro approccio è quello di effettuare gli interventi prima dello sviluppo delle retrazioni per cercare di bilanciare l’equilibrio fra muscoli agonisti ed antagonisti quando la forza è ancora conservata (13). Tale approccio introdotto oltre venti anni fa viene oggi seguito in pochi centri.
Fase intermedia di deambulazione
Gli interventi in questa fase si propongono di prolungare la deambulazione visto che un’articolazione retratta può limitare la marcia, anche se la forza muscolare delle gambe è conservata. Ci sono alcune evidenze che suggeriscono che la deambulazione può essere prolungata dall’intervento chirurgico per 1-3 anni (5), ma raggiungere un consenso sulla correzione chirurgica delle retrazioni per prolungare la deambulazione è difficoltoso, perché è difficile valutare oggettivamente i risultati ottenuti. I pazienti non operati e non trattati con steroidi perdono la capacità di deambulare ad un’età molto variabile. Conseguentemente, l’utilizzo di un’età media per confrontare l’efficacia di un particolare intervento non è statisticamente rilevante se valutato su un basso numero di pazienti. Alcuni studi hanno dimostrato che, più che un’improvvisa perdita della deambulazione, la capacità di deambulare si riduce gradualmente nel giro di 1-2 anni. Questo rende più difficile dimostrare un prolungamento della deambulazione dopo uno specifico intervento.
Tale difficoltà è stata ulteriormente aumentata dall’introduzione di un’ulteriore variabile, quale l’effetto degli steroidi che possono prolungare la deambulazione autonoma. In ogni caso la forza muscolare e la capacità di movimento delle articolazioni dovrebbero essere valutate prima di decidere per un eventuale intervento chirurgico.
L’approccio chirurgico agli arti inferiori per il mantenimento della deambulazione include interventi effettuati contemporaneamente a più livelli e bilateralmente (anca-ginocchio-caviglia o ginocchio-caviglia), interventi ad un singolo livello bilateralmente (caviglia), e, raramente interventi ad un singolo livello da un solo lato in caso di coinvolgimento articolare asimmetrico (5). Gli interventi possono essere l’allungamento dei tendini, la trasposizione tendinea, la tendinotomia, assieme allo sbrigliamento delle retrazioni articolari fibrotiche (caviglie) o alla rimozione di fasci fibrotici (benderella ileo tibiale). L’intervento ad un singolo livello (correzione delle deformità in equinismo delle caviglie > 20°) non è indicato se ci sono retrazioni alla flessione del ginocchio di 10° o più e una forza del quadricipite di grado 3/5 o meno. La deformità del piede in equinismo (deambulazione sulle punte) e altre deformità del piede (inversione severa) possono essere corrette dall’allungamento del tendine d’Achille e il trasferimento del tendine del tibiale posteriore attraverso la membrana interossea sulla faccia dorso laterale del piede così da cambiare l’attività di flesso-inversione plantare del tibiale posteriore in dorsi flessione-eversione (5). L’allungamento del tendine del ginocchio è generalmente necessario se c’è una retrazione in flessione del ginocchio superiore a 15°.
Dopo l’allungamento e la trasposizione del tendine, un successivo utilizzo di tutori KAFOs con correzione graduale è necessario per mantenere i risultati ed evitare le recidive. Quando l’intervento è effettuato per mantenere la deambulazione, il paziente deve essere mobilizzato usando un deambulatore il primo o il secondo giorno post-intervento così da prevenire l’ulteriore atrofia da non uso dei muscoli delle gambe. La deambulazione dopo l’intervento deve essere recuperata mediante una mirata riabilitazione post ingessatura.
Pertanto è necessario perciò un team esperto ed una stretta collaborazione tra chirurgo ortopedico, fisiatra, fisioterapista ed officine ortopediche.
Fase tardiva di deambulazione
Malgrado i primi promettenti risultati, gli interventi chirurgici nella fase tardiva di deambulazione risultano generalmente inefficaci.
Fase iniziale dopo la perdita della deambulazione
Nella fase iniziale dopo la perdita della deambulazione, alcuni centri consigliano di effettuare interventi di allungamento/tenotomia tendinei a più livelli agli arti inferiori e un successivo posizionamento di tutori per riprendere la deambulazione entro 3-6 mesi dopo la sua interruzione. In linea generale, questo approccio è inefficace e, pertanto, è considerato inappropriato.
Fase tardiva dopo la perdita della deambulazione
Deformità dei piedi severe di più di 30° in equinismo possono essere corrette con l’allungamento dei tendini d’Achille o la tenotomia e deformità in varismo (se presenti) con la trasposizione del tendine tibiale posteriore, l’allungamento o la tenotomia. Questo approccio è consigliato solo per problemi specifici di tipo sintomatico, generalmente per alleviare il dolore e ed evitare eventuali lesioni cutanee da decubito causate dal non corretto posizionamento dei piedi sulla pedana della carrozzina.
Scoliosi
Pazienti non trattati con steroidi hanno un’alta probabilità di sviluppare una scoliosi significativa e progressiva ed una bassa probabilità di sviluppare una frattura vertebrale da compressione dovuta all’osteoporosi.
In particolare, l’utilizzo di steroidi ha ridotto il rischio di scoliosi (14), benchè non sia ancora chiaro se i steroidi riducano il rischio di scoliosi a lungo termine o ne ritardino l’esordio. E’ stato inoltre dimostrato che altri fattori, quali il prolungamento della deambulazione autonoma mediante tutorizzazione con KAFOs, possono avere un effetto positivo sulla progressione della scoliosi (14).
La gestione della scoliosi dovrebbe coinvolgere un chirurgo ortopedico esperto in tale campo, e consiste nel monitoraggio della scoliosi, nel supportare la simmetria della colonna e della pelvi ed il corretto posizionamento della colonna con sistemi di supporto della seduta della carrozzina.
In particolare nei pazienti che usano i steroidi, rilevando la presenza di eventuali fratture vertebrali dolorose. Il monitoraggio della scoliosi va effettuato con l’osservazione clinica ambulatoriale e radiografie della colonna solo se la scoliosi è già presente.
Nella fase successiva alla perdita della deambulazione, il controllo clinico della scoliosi è necessario ad ogni visita.
L’esame radiografico della colonna è indicata nella fase iniziale di utilizzo continuativo della carrozzina e deve essere eseguito con proiezioni antero-posteriori dell’intera colonna e, a paziente seduto, in proiezione laterale. Una radiografia antero-posteriore della colonna è necessaria annualmente per curve scoliotiche di meno di 15-20° ed ogni 6 mesi per curve maggiori di 20°, a prescindere dal trattamento con steroidi, e fino alla maturità ossea. Un intervallo di più di un anno, tra una radiografia e l’altra, aumenta il rischio di non accorgersi di un peggioramento della curvatura. Raggiunta la maturità ossea, la decisione sull’effettuare una radiografia si baserà sull’osservazione clinica. L’artrodesi è effettuata per rinforzare la colonna vertebrale, prevenire successivi peggioramenti delle deformità, eliminare il dolore dovuto alle fratture successive ad osteoporosi, e rallentare il declino respiratorio. L’artrodesi anteriore non è indicata nei DMD. L’artrodesi posteriore è consigliata solo in pazienti in carrozzina che hanno una curvatura di oltre 20° e progressiva, che non utilizzano corticosteroidi e che devono ancora raggiungere la maturità ossea (5,14).
In pazienti che assumono corticosteroidi l’opzione chirurgica può essere consigliata se la curvatura progredisce ed è associata a fratture vertebrali e dolore nonostante l’utilizzo di terapia per il rinforzo osseo, a prescindere dalla maturazione scheletrica.
La scelta del tempo corretto per effettuare l’intervento chirurgico è comunque ancora un argomento molto discusso in letteratura e va sempre valutata con attenzione nel singolo caso, tenendo in considerazione le caratteristiche della curvatura nel tempo e l’andamento della capacità respiratoria e cardiaca. Un’attesa eccessiva può rendere impossibile l’effettuazione dell’intervento a causa di un rischio anestesiologico troppo alto legato alla situazione respiratoria e/o cardiaca.
Riguardo il livello della stabilizzazione chirurgica della scoliosi, se c’è un’obliquità pelvica di più di 15° è necessario effettuare una correzione e stabilizzazione con fusione ossea dalla parte superiore della regione toracica fino al sacro. Se non c’è obliquità pelvica, si può intervenire fino al suddetto livello, ma un intervento fino alla quinta vertebra lombare può essere efficace. L’utilizzo del corsetto va considerata per rimandare l’intervento fino ad un’età più idonea o nel caso di pazienti che non accettano l’opzione chirurgica o che hanno rischi operatori troppo elevati.
Fratture
Il rischio di fratture, da alcuni considerato alto nella DMD, è sicuramente aumentato nel paziente DMD che assume steroidi
Tenendo in considerazione le linee guida per l’anestesia sicura nella DMD (15), la fissazione interna è consigliata in caso di fratture gravi agli arti inferiori in pazienti deambulanti in modo da permettere una rapida riabilitazione e di aumentare le possibilità di mantenere la deambulazione. Nei pazienti non deambulanti, il bisogno di una fissazione interna è meno pressante. L’utilizzo di tutori o gessi è necessario per i pazienti non deambulanti, ed è appropriato nei pazienti deambulanti se è il modo più rapido e sicuro per promuovere la risoluzione della frattura e per non compromettere la deambulazione durante la guarigione.
5. ASPETTI RESPIRATORI
La progressiva compromissione dei muscoli respiratori, tipica nella storia naturale della DMD, porta ad un graduale indebolimento della tosse, che si manifesta soprattutto durante le infezioni respiratorie, e ad una riduzione della ventilazione alveolare, che determina lo sviluppo di ipercapnia (CO2 ematica > 45 mmHg) prima solo notturna e poi anche diurna. Ne derivano importanti complicanze respiratorie (insufficienza respiratoria cronica ipercapnica, insufficienza respiratoria acuta durante infezioni della alte vie respiratorie, polmoniti, atelettasie), che possono risultare fatali, se non adeguatamente trattate . La prevenzione ed il tempestivo trattamento delle complicanze respiratorie riduce la morbilità e la mortalità della DMD (5,16,17.)
Il percorso assistenziale respiratorio raccomandato per il paziente affetto da DMD è riassunto in figura 1.

Figura 1. Percorso assistenziale respiratorio del paziente affetto da DMD. CVF, capacità vitale forzata; PCF, picco della tosse; NIV, ventilazione non invasiva; IV, ventilazione invasiva
Sono elencate di seguito le principali raccomandazioni per la gestione respiratoria dei pazienti affetti da DMD (5,17)
1) Controllo dell’efficacia della tosse e della ventilazione sia diurna che notturna
I sintomi respiratori iniziali, nella maggioranza dei casi, sono minimi, mascherati da una più generale debolezza muscolare e dalla riduzione dell’attività motoria. Per queste ragioni è indispensabile il monitoraggio periodico della funzionalità respiratoria ed un’attenta valutazione dei sintomi.
La misura raccomandata per valutare l’efficacia dei muscoli respiratori è la capacità vitale forzata (CVF) in posizione seduta. Tale esame è consigliato annualmente dopo il compimento del sesto anno di vita, ed ogni 6 mesi se la CVF è <80% del predetto o dopo la perdita della deambulazione autonoma.
Per completare i controlli, appaiono utili la misura della saturazione arteriosa e la ricerca anamnestica dei segni e sintomi di ipoventilazione notturna (affaticamento, cefalea mattutina o continua, ipersonnia diurna, difficoltà a concentrarsi, frequenti risvegli notturni, frequenti incubi, risvegli con dispnea e tachicardia). In caso di sintomi di ipoventilazione o se la CVF è < 50% del predetto va associata la misura della capnia diurna (capnografia, misura della CO2 transcutanea o emogasanalisi capillare al lobo dell’orecchio). L’emogasanalisi capillare consente anche di misurare il livello dei bicarbonati e l’eccesso di basi, il cui incremento (eccesso di basi > 4 mmol/L) è predittivo di ipercapnia notturna.
Gli studi respiratori notturni (saturimetria notturna o polisonnografia idealmente associate alla registrazione continua della CO2) sono indicati almeno una volta all’anno, se la CVF è <40% del predetto o < 1,25 L, se compaiono sintomi di ipoventilazione notturna, se la CO2 diurna è >45 mmHg o se la saturazione diurna è <95%. Se non è possibile effettuare la registrazione continua della CO2 sarebbe utile effettuare l’EGA capillare al risveglio. La polisonnografia è l’unico studio respiratorio notturno in grado di evidenziare disturbi del sonno non associati ad alterazioni degli scambi gassosi.
Quando il paziente perde la capacità di deambulare autonomamente va effettuata una valutazione dell’efficacia della tosse ogni 6 mesi attraverso la misurazione del picco della tosse (PCF).
L’Rx torace, l’emocromo e la misura dei bicarbonati è indicata annualmente dopo che il paziente ha perso la capacità di deambulare autonomamente.
La misura della massima pressione inspiratoria (MIP) e della massima pressione espiratoria (MEP) sono misure opzionali che completano la valutazione dell’efficacia dei muscoli respiratori..
Nei pazienti che necessitano di assistenza meccanica della tosse o della ventilazione i controlli respiratori devono essere effettuati ogni 3-6 mesi.
2) Prevenzione delle infezioni delle vie respiratorie
La vaccinazione antipneumococcica è indicata per i pazienti affetti da DMD di età >2 anni, la vaccinazione antiinfluenzale per quelli di età >6 mesi.
3) Manovre di reclutamento alveolare
Le manovre di reclutamento alveoare effettuate tramite la macchina della tosse o tramite pallone di Ambu sono indicate quando la FVC è < 40%.
4) Addestramento all’assistenza manuale e meccanica alla tosse
L’addestramento all’assistenza manuale (spinta addominale e/o toracica e “air stacking”) e meccanica (macchina della tosse) alla tosse è indicato nel soggetto adulto quando il PCF è <270L/min. Non è ancora stato validato un analogo valore soglia per la popolazione pediatrica.
5) Ventilazione meccanica a pressione positiva
Inizialmente è necessaria solo di notte, successivamente anche di giorno. Il “timing” di tale progressione è riassunto in figura XYZ. E’ fortemente raccomandato l’utilizzo della ventilazione non invasiva (NIV) anche nei pazienti totalmente dipendenti dal ventilatore. La ventilazione tramite tracheotomia è indicata solo in caso di insuccesso della NIV, inadeguata gestione delle secrezioni bronchiali con la tosse assistita, severa disfunzione bulbare o in caso di preferenza del paziente.
Possono essere usate modalità volumetriche o pressometriche; comunque è raccomandato l’utilizzo di una frequenza respiratoria minima impostata. Durante la NIV sono utilizzate come interfaccia principalmente la maschera nasale e le olive nasali. Durante la ventilazione diurna è anche possibile utilizzare il boccaglio.
6) Addestramento a protocolli di gestione domiciliare delle riacutizzazioni respiratorie
La gestione ospedaliera durante riacutizzazione è gravato da alto tasso di complicanze e fallimento, mentre la gestione domiciliare da parte di care-givers ben addestrati è associata ad un maggior tasso di successo (16). Pertanto tutti i pazienti a rischio di insufficienza respiratoria acuta (PCF < 270 L/min) dovrebbero essere addestrati all’utilizzo della NIV, della macchina della tosse e del saturimetro portatile (16).
7) Gestione delle riacutizzazioni respiratorie
Durante le riacutizzazioni respiratorie il paziente dovrebbe estendere l’utilizzo della NIV anche nelle ore diurne. Quando la saturazione arteriosa (SatO2) è < 95% in aria ambiente il paziente deve essere assistito con macchina della tosse in modo aggressivo sino ad ottenere un aumento della SatO2> 95%. L’utilizzo dell’ossigeno è sconsigliato se non per brevi periodi e comunque in associazione alla NIV. L’utilizzo degli antibiotici è consigliato sempre in presenza di SatO2 <95%. L’utilizzo della telemedicina in teleassistenza, cioè con possibilità di trasmissione dei dati al bisogno e di teleconsulenza specialistica 24 ore/die 7 giorni/settimana, potrebbe migliorare la gestione domiciliare delle riacutizzazioni respiratorie. A questo proposito, in alcune Regioni sono già in corso progetti pilota di Telemedicina.
In caso di fallimento del protocollo domiciliare il paziente deve essere ricoverato in reparti di cure intensive dove proseguire la NIV ed attuare un trattamento aggressivo delle secrezioni bronchiali con macchina della tosse. In caso di fallimento dell’approccio non invasivo, il paziente deve essere intubato. Al miglioramento del quadro clinico, il paziente dovrebbe essere estubato ed assistito immediatamente in NIV associata ad assistenza meccanica della tosse (18)
6. ASPETTI CARDIOLOGICI
Il coinvolgimento del muscolo cardiaco nella DMD e nella BMD rappresenta una delle principali complicazioni della malattia; dopo i progressi della terapia di supporto ventilatorio, è diventato la principale causa di mortalità nella DMD.
La sostituzione fibro-adiposa del muscolo cardiaco inizia a svilupparsi precocemente, prima che compaiano i segni clinici di cardiopatia, per cui è molto importante monitorizzare la funzione in modo da rilevare con tempestività la comparsa di minime alterazioni (in particolare della funzione ventricolare), momento in cui è consigliato l’inizio della terapia farmacologica, indipendentemente dall’età del paziente. Nella maggior parte dei pazienti l’interessamento cardiaco evolve verso una cardiomiopatia dilatativa, con o senza disturbi del ritmo e decorso progressivo, che porta a insufficienza cardiaca cronica. Spesso i segni clinici tipici della compromissione cardiaca (affaticamento, perdita di peso, vomito, dolore addominale, alterazioni del sonno, e impossibilità a condurre le normali attività quotidiane) sono mascherati dalle limitazioni motorie e possono essere rilevati solo in fase avanzata e irreversibile, specialmente nella forma di Duchenne, confinata in carrozzina ad un’età più precoce. D’altra parte i pazienti Becker sembrano pagare la possibilità di un tempo più prolungato di deambulazione con un maggior e più precoce sviluppo di cardiomiopatia dilatativa grave.
E’ quindi di primaria importanza impostare un programma di follow-up periodico con valutazione clinica e esami strumentali non invasivi, grazie ai quali è possibile riconoscere precocemente l’inizio dell’interessamento cardiaco (in genere tra i 10 e i 15 anni, ma talvolta anche prima). Alcuni recenti studi suggeriscono un migliore decorso quando la terapia viene iniziata anche prima della comparsa dei segni di deficit funzionale108; divergenze permangono sull’età minima per l’inizio della terapia cardiologia, per cui si attendono conferme da casistiche su un più ampio gruppo di pazienti.
Attualmente sono disponibili due Linee Guida (19,20) sulla assistenza cardiologica nella DMD.
Il follow-up cardiologico deve essere condotto da uno specialista esperto in malattie neuromuscolari. La prima valutazione cardiologica deve essere effettuata al momento della diagnosi, allo scopo di escludere altre possibili alterazioni cardiologiche concomitanti, tipiche dell’età infantile (difetti del setto interatriale o interventricolare, persistenza di pervietà del dotto) che possono concorrere all’evoluzione della cardiomiopatia, mediante esami semplici e non invasivi, quali l’ECG e l’Ecocardiogramma; successivamente sono consigliabili almeno un ECG e un Ecocardiogramma annuali fino al compimento del decimo anno di età, quando la probabilità di evidenziare l’interessamento cardiaco inizia ad aumentare. La frequenza dei controlli cardiologici deve diventare semestrale, dopo i 10 anni di età o anche più ravvicinati (spesso mensili e/o settimanali) quando compaiono precocemente segni e/o sintomi di scompenso. Nei pazienti in cui le deformità toraciche rendessero difficoltosa l’esecuzione dell’ecocardiogramma, può rivelarsi utile una RMN cardiaca
Per quanto riguarda il trattamento farmacologico, vi è consenso generale sull’uso degli ACE-Inibitori come farmaco di prima scelta, seguiti da beta-bloccanti, digitale, diuretici, anticoagulanti, nei casi di scompenso cardiaco congestizio. Importante resta sempre il monitoraggio degli elettroliti, in quanto squilibri di Na+, K+ e Mg++ possono scatenare l’insorgenza di aritmie fatali.
I disturbi del ritmo più frequentemente osservati sono tachicardia sinusale, extrasistolia, disturbi della conduzione atrio-ventricolare; più raramente bradicardia. In tutti questi casi è importante sottoporre il paziente ad ECG dinamico secondo Holter per 24 h, allo scopo di chiarire la natura e la genesi delle aritmie, in particolare se il paziente lamenta palpitazione o malesseri improvvisi.
In caso di aritmie ipercinetiche refrattarie al trattamento farmacologico con antiaritmici, può essere utile l’impianto di un defibrillatore.
Nei pazienti DMD/BMD trattati con steroidi (prednisone o deflazacort), studi recenti hanno dimostrato un ruolo protettivo sulla funzione ventricolare sinistra (FE), con ritardo nella comparsa della cardiomiopatia. Se monitorizzati con controlli periodici, i paventati effetti collaterali (aumentato rischio di ipertensione ed eventi trombo embolici) sono trascurabili, sia perché la maggior parte dei pazienti DMD/BMD presenta ipotensione arteriosa, sia per l’attuazione di una terapia anticoagulante preventiva, nei casi con grave cardiomiopatia dilatativa.
Grazie al miglioramento generale delle condizioni di salute dei pazienti con DMD, ed al trattamento ventilatorio preventivo, l’aspettativa di vita di questi pazienti risulta significativamente aumentata (più di due volte negli ultimi 20 anni).
Ci si augura pertanto che in un prossimo futuro, il trapianto cardiaco, in particolare nei pazienti che presentano una precoce cardiomiopatia dilatativa possa essere preso in considerazione come valida alternativa terapeutica, in attesa dei progressi della terapia genica.
7. ASPETTI DELLA NUTRIZIONE, DELLA DEGLUTIZIONE, GASTROINTESTINALI E DEL LINGUAGGIO
I pazienti con DMD possono avere, nelle varie età della vita, specifici problemi legati ad una ridotta o inadeguata capacità nutritiva, sia perché obesi o per un ridotto apporto di calorie, proteine, vitamine, minerali e liquidi. Negli stadi avanzati della malattia, la debolezza dei muscoli faringei può portare alla disfagia, accentuando i problemi nutrizionali e la progressiva riduzione della forza dei muscoli respiratori in combinazione con un ridotto apporto alimentare; tale situazione può provocare una marcata perdita di peso e la necessità di una nutrizione parenterale (5).
La stipsi può essere presente nei pazienti con maggiore durata di malattia o dopo interventi chirurgici. La prolungata sopravvivenza ha evidenziato altre problematiche legate ad una eccessiva dilatazione gastrica ed intestinale, causata da abnorme ingestione di aria dovuta all’uso prolungato di apparecchi per la ventilazione assistita o, più raramente, ad un rallentato svuotamento intestinale.
Con il progredire della malattia e’ necessario consultare un dietologo o un nutrizionista, un logoterapista e un gastroenterologo per:
- indirizzare il paziente al mantenimento di un livello nutrizionale sufficiente a prevenire la denutrizione o l’obesità e utilizzare una alimentazione più completa possibile (eventualmente anche sondino o per via parenterale)
- monitorare e trattare i problemi della deglutizione, prevenire aspirazione e perdita di peso e trattare i problemi del linguaggio;
- trattare i comuni problemi di stipsi e reflusso gastroesofageo con terapie farmacologiche e non.
Gestione dei problemi nutrizionali
E’ necessario il mantenimento di una condizione nutrizionale adeguata, definita come peso per età o massa corporea tra 10° e 85° percentile. Un livello nutrizionale inadeguato può avere un’influenza negativa su tutti gli organi; pertanto la prevenzione di tali problemi e/o dell’obesità deve essere un obiettivo da perseguire sin dall’epoca della diagnosi della malattia e quindi per tutta la vita.
Il regime alimentare deve essere basato su parametri energetici quali proteine, liquidi, calcio, vitamina D ed altri principi nutrizionali; l’instaurarsi di una condizione caratterizzata da una marcata riduzione o da un eccesso di peso deve essere tempestivamente riferita ad un dietologo. E’ particolarmente importante che ogni paziente riceva quotidianamente un apporto multivitaminico, specie con vitamina D e minerali.
Se esiste il sospetto specifico di una dieta scadente, bisogna dosare il livello delle vitamine nell’organismo e, eventualmente, consigliare una adeguata terapia sostitutiva.
Gestione dei problemi della deglutizione
Un esame clinico della capacità di deglutizione è indicato specie se è presente una perdita di peso maggiore del 10%, oppure un mancato aumento di peso secondo quanto previsto per le varie età.
Un eccessivo prolungamento del tempo impiegato per un pasto o un pasto accompagnato da facile affaticamento, fuoriuscita dei cibi dalla bocca, perdita di saliva o qualunque altro segno di disfagia, suggeriscono una visita specialistica, così come una tosse persistente, senso di soffocamento, conati di vomito o “voce gorgogliante” durante l’ingestione di cibi solidi o di liquidi.
Anche un episodio di polmonite da aspirazione, una inspiegabile alterazione della funzione polmonare o una febbre di origine sconosciuta possono essere segnali di una deglutizione a rischio che necessita uno studio specifico. Uno studio videofluoroscopico della deglutizione è indicato per i pazienti con dismotilità faringea o possibile polmonite da aspirazione.
Gli interventi per migliorare la deglutizione e le relative strategie di supporto possono essere suggerite da un logopedista esperto nel trattamento della disfagia che proponga un piano di intervento personalizzato tale da mantenere la migliore efficienza della deglutizione.
Con il progredire della malattia, molti pazienti, specie giovani adulti, cominciano a lamentare difficoltà nel masticare e nel deglutire, anche se talora i sintomi iniziali possono essere sottovalutati dai pazienti stessi. Questa condizione può portare a complicazioni quali la polmonite da aspirazione o l’incapacità ad introdurre nell’organismo sufficienti quantità di liquidi e/o di cibo, tali da far mantenere al paziente il giusto peso. Se l’alimentazione e l’idratazione per via orale diventano difficoltose, bisogna proporre l’applicazione di un sondino naso-gastrico. Successivamente, se le difficoltà di alimentazione aumentano, bisogna ricorrere ad una gastrostomia da eseguire per via endoscopica o chirurgica, tenendo in conto gli aspetti anestesiologici ed etici e la volontà del paziente e/o della famiglia.
Gestione dei problemi gastrointestinali
Nella pratica quotidiana i più comuni disturbi gastrointestinali dei pazienti con DMD sono stipsi e reflusso gastroesofageo. Se il paziente lamenta stipsi acuta o ritenzione fecale, è consigliato l’uso di farmaci lassativi o che stimolino la defecazione o che riescano ad ammorbidire le feci, e, occasionalmente, anche di clisteri. Se vi è persistenza dei sintomi, è necessario l’utilizzo quotidiano di lassativi quali magnesia, lattulosio e glicol polietilenico; inoltre è opportuno adeguare anche la quantità dei liquidi ingeriti dal paziente. In caso di ritenzione fecale , le manovre manuali, in sedazione o in anestesia generale, non hanno dato sempre i risultati sperati; e’ comunque utile trattare prima i pazienti con lassativi stimolanti quali bisacodyl e semi di senna.
Clisteri con latte e melasse non sono particolarmente raccomandati per i pazienti pediatrici; una nutrizione con alimenti ricchi di fibre può anche peggiorare i sintomi se non viene somministrata una adeguata quantità di liquidi.
Il reflusso gastroesofageo viene generalmente trattato con inibitori di pompa protonica o con antagonisti dei recettori H2 o con procinetici, sucralfato ed antiacidi come possibili terapie aggiuntive. Nei pazienti con reflusso gastroesofageo appare utile cercare di mantenere un adeguato regime nutrizionale.
Nei pazienti in terapia con corticosteroidi, devono essere consigliati prescritti protettori gastrici e bifosfonati per evitare complicazioni quali gastrite o esofagite da reflusso.
Gestione dei problemi della parola e della comunicazione.
Una ritardata acquisizione delle tappe del linguaggio è comune nei bambini con DMD, con una differenza tra difetti di acquisizione del linguaggio e di abilità verbali che possono persistere durante tutta l’adolescenza. E’ senz’altro utile consultare un logopedista per avere una valutazione ed un trattamento del bambino ove esista un fondato sospetto di difficoltà nell’acquisizione della parola o per continue difficoltà nella comprensione del linguaggio.
Una terapia con esercizi riguardanti l’articolazione della parola e la motricità è consigliabile nei bambini con DMD che mostrano ipotonia ed anche nei pazienti di maggiore età che hanno un deterioramento della forza dei muscoli mimici e/o una alterata capacità di espressione verbale.
Per i pazienti più grandi d’età, strategie compensatorie, esercizi vocali ed amplificazione della parola appaiono tecniche appropriate di intervento riabilitativo in caso di peggioramento della capacità di espressione, in particolare per la parola e per l’intensità della voce, o anche nei pazienti con respirazione assistita. Una consulenza per valutare la capacità vocale e’ sicuramente utile a tutte le età specie quando si nota che le qualità fonatorie sono ridotte.
Nei casi di impossibilità alla comunicazione verbale, solitamente un evento tardivo del corso della malattia, il CdR deve provvedere al monitoraggio della funzione comunicativa e all’individuazione dell’ausilio di comunicazione aumentativa più adeguato, attivando le procedure di prescrizione necessarie.
Quando insorge una condizione di totale impossibilità alla comunicazione anche non verbale, i comunicatori ad alta tecnologia, basati sul rilevamento del movimento oculare, costituiscono una valida risposta e devono essere forniti dal SSN, come già avviene per la SLA.
8. ASPETTI PSICOSOCIALI
La presa in carico di un bambino/ragazzo affetto da DMD e del nucleo familiare deve comprendere anche una particolare attenzione agli aspetti emotivo-relazionali e neuropsicologici, aree entrambe ad alto rischio in considerazione del tipo di malattia .
Per quanto la letteratura concernente questi aspetti sia limitata, è noto che per alcune famiglie il dolore e il vissuto di lutto rispetto alla malattia possono precedere le continue preoccupazioni legate alle obiettive e quotidiane difficoltà correlate al progressivo avanzare della malattia e delle sue complicazioni ed è ben più importante delle obiettive difficoltà connesse ai deficit motori dovuti alla malattia: si tratta infatti di una malattia progressiva, geneticamente determinata, prevedibilmente connessa ad una ridotta durata della vita e a forti limitazioni nella vita quotidiana (5,21) .
E’ abbastanza comprensibile come tutto questo incida pesantemente sul vissuto e sugli equilibri familiari (es. fratelli sani) e sulle interazioni sociali di tutto il nucleo familiare. Naturalmente le esigenze e le problematiche variano a seconda dell’età, della fase della malattia e anche del singolo paziente, ma vi sono alcuni aspetti generali da considerare.
La DMD è ormai considerata una malattia multi sistemica e la carenza della Distrofina e delle sue isoforme in alcune aree altamente specializzate del SNC è alla base verosimilmente di alcuni dei problemi riscontrati in una parte dei soggetti affetti (22). Tuttavia molto deve essere ancora chiarito in tal senso sia sul piano patogenetico, sia sul piano clinico. Inoltre fattori sociali ed emotivo-relazionali, in aggiunta alle terapie farmacologiche (per esempio lo steroide) possono contribuire all’espressione clinica di questi aspetti.
Il trattamento deve prevedere le stesse strategie supportate dall’evidenza scientifica che si utilizzerebbero per risolvere problemi analoghi in soggetti non affetti da DMD, ponendo l’enfasi sulla prevenzione e il trattamento precoce.
In genere l’adattamento psicosociale dei ragazzi affetti da DMD è analogo a quello di altri soggetti affetti da malattie croniche. Tuttavia si possono individuare alcune specifiche aree di rischio (23). Le difficoltà nell’inserimento sociale possono essere dovute a deficit biologicamente determinati riguardanti alcune specifiche abilità cognitive, quali ad esempio la reciprocità ed il giudizio sociale o la discriminazione affettiva, sebbene le stesse limitazioni fisiche della DMD, possono determinare certe forme di isolamento ed un ridotto accesso alla socializzazione.
Sono ben documentate le problematiche relative alle competenze linguistiche, che includono problemi nello sviluppo del linguaggio, la memoria verbale a breve termine , il deficit cognitivo e disturbi specifici di linguaggio. Va considerato in particolare che una discreta percentuale di bambini affetti da DMD, anche con livello cognitivo adeguato, possono sviluppare problemi nella letto-scrittura e nelle abilità aritmetiche: sebbene a rigore la diagnosi di dislessia, disortografia e discalculia non possa essere applicata perché prevede l’assenza di qualsiasi altra patologia, tali deficit vanno comunque considerati e trattati con gli stessi strumenti (vedi Consensus Conference sui Disturbi specifici dell’apprendimento [DSA], Milano 2007)
Nella letteratura viene riportato un elevato rischio di disturbi comportamentali e di disordini pervasivi dello sviluppo, inclusi disturbi dello spettro autistico, disturbo da deficit di attenzione con iperattività e disturbo ossessivo-compulsivo. In Italia, l’esperienza clinica non sembra confermare uan percentuale così elevata di questi disturbi coem segnaalto nella letteratura anglosassone, per cui viene ribadita l’importanza di associare sempre, durante la somministrazione delle scale, anche l’osservazione clinica dei bambini, fatta da specialisti NPI.
I ragazzi affetti da DMD possono anche sviluppare problemi di adattamento e depressione, oppure disturbi di tipo ansioso, magari amplificati da un possibile deficit cognitivo riguardante soprattutto la flessibilità e l’adattabilità (struttura iper-rigida); gli stessi problemi possono generare un disturbo oppositivo-provocatorio e problemi di comportamento esplosivo.
L’elevata frequenza di disturbi depressivi nei genitori di bambini affetti da DMD rende assolutamente necessario garantire la possibilità di effettuare una valutazione e fornire di un supporto specifico per l’intero nucleo familiare
Valutazioni: quando e come
I momenti cruciali nei quali effettuare una valutazione clinica di queste problematiche sono:
- il momento della diagnosi, o meglio dopo un intervallo di 6-12 mesi dopo la comunicazione diagnostica
- il periodo precedente l’inizio del periodo scolare
- dopo il verificarsi di significative perdite di funzione (es., perdita della deambulazione, inizio della NIV)
Le valutazioni devono avere come obiettivo le aree dell’aggiustamento emozionale, le strategie adottate per affrontare le difficoltà, lo sviluppo cognitivo, le funzioni neuropsicologiche, lo sviluppo del linguaggio, la possibile presenza di disturbi dello spettro autistico e il supporto sociale.
E’ importante prevedere uno screening del benessere psicosociale nel paziente e nel nucleo familiare.
Interventi
Naturalmente le strategie di intervento dovranno essere individualizzate, ma devono comunque garantire un adeguato supporto per un ampio spettro di necessità.
Di cruciale importanza per la salute psicoemotiva e il benessere sociale del paziente e del suo nucleo familiare è l’individuazione di un Coordinatore assistenziale o “Care manager” che deve diventare punto di riferimento per le famiglie e deve possedere una adeguata conoscenza ed esperienza specifica nell’ambito delle malattie neuromuscolari.
E’ inoltre importante fornire un aiuto attivo alle famiglie con pazienti DMD al fine di superare i problemi sociali e il possibile isolamento che può si verificare soprattutto in età adulta.
E’ necessario stabilire un Piano Educativo Individuale (PEI) che preveda la differenziazione degli obiettivi - solo se necessario e in base al livello cognitivo o al quadro clinico - per tutti i bambini DMD in accordo con i genitori e gli insegnanti, rivolto a potenziali specifici disturbi di apprendimento e trovando il modo di modificare attività che potrebbero altrimenti risultare dannose per il bambino.
E’ importante che durante l’attività scolastica il bambino possa partecipare, senza tuttavia affaticarsi eccessivamente né mettere in pericolo la propria incolumità, ad attività motorie collettive (giochi, educazione fisica), studiando ruoli idonei alle sue abilità motorie e tuttavia in modo che non si senta escluso né discriminato per le sue ridotte abilità motorie. La scelta delle attività andrà fatta di volta in volta in relazione allo stadio della malattia e alle condizioni del singolo ragazzo.
E’ anche fondamentale che possa partecipare alle gite scolastiche come i suoi compagni (per esempio senza necessariamente la presenza dei genitori) prevedendo tuttavia insieme agli insegnanti e alla classe percorsi che consentano soste – se necessarie per la stanchezza- senza impedire ai coetanei di portare a termine la gita. Utile inoltre prevedere, in simili manifestazioni, la presenza di un accompagnatore in più che possa staccarsi dal gruppo se necessario e dedicarsi al bambino.
Quando le difficoltà di deambulazione sono più marcate, è importante che si lavori sia con il bambino che con i genitori con largo anticipo e tatto per introdurre l’uso della carrozzina e consentire gli spostamenti in sicurezza e senza eccessivo affaticamento. Tutto ciò richiede particolare attenzione affinchè la scuola provveda all’uso di bus che consentano la salita per disabili e dei percorsi senza barriere architettoniche.
La somministrazione di psicofarmaci va considerata in caso di sintomi psichiatrici di gravità moderata/severa, come parte di un piano di trattamento multimodale che includa anche psicoterapia ed interventi pedagogici (educativi). Per ogni psicofarmaco vanno considerate le indicazioni specifiche relative all’età evolutiva e inoltre è necessario considerare una attenta valutazione della funzionalità cardiaca, l’interazione tra farmaci e i loro effetti collaterali, meglio se con il consiglio di uno specialista.
Se necessario, è importante ricorrere alle cure palliative per ridurre o prevenire la sofferenza e migliorare la qualità della vita di questi pazienti.
Oltre alla terapia del dolore, chi si occupa di cure palliative deve garantire anche un supporto emotivo e spirituale, assistere le famiglie nell’individuazione degli obiettivi e nel prendere le decisioni più impegnative, facilitare la comunicazione tra le famiglie e i medici, con particolare attenzione ai sentimenti di dolore e di lutto.
9. TRATTAMENTO DEL DOLORE
Il dolore è molto variabile nella DMD: può presentarsi con modalità variabili da un soggetto all’altro e nelle differenti fasi della malattia. In genere in tutti è correlato a problemi posturali, di affaticamento, di eccessivo o errato trattamento riabilitativo; non va sottovalutata l’ipotesi di fratture anche in assenza di traumi, soprattutto in chi assume steroidi.
Il trattamento può essere costituito da interventi di terapia fisica, dalla correzione della postura anche attraverso l’impiego di ortesi individualizzate, supporti per carrozzina, materassi e cuscini in materiali speciali, che devono essere previsti nel Nomenclatore nazionale; l’intervento farmacologico è rappresentato dall’uso di FANS e di antidolorifici centrali, da utilizzare con cautela rispetto ai possibili effetti collaterali anche respiratori.
10. PROBLEMI ANESTESIOLOGICI E ACCESSI IN PRONTO SOCCORSO
Se un paziente affetto da DMD deve essere sottoposto a intervento chirurgico (per biopsia muscolare, allungamento dei tendini, correzione della scoliosi, riduzioni di fratture) l’anestesia generale può essere effettuata, anche se con rischio aumentato, a qualsiasi età con alcune precauzioni e con una adeguata programmazione, quando possibile. L’intervento deve essere eseguito in un centro chirurgico esperto, con disponibilità di un’area di terapia intensiva e subintensiva per il monitoraggio post-operatorio, attrezzata per la messa in atto di tutte le misure assistenziali pre- e post-operatorie (ventilazione non invasiva e assistenza alla tosse).
Particolare attenzione deve essere posta al mantenimento della temperatura corporea e alla limitazione della perdita di volume ematico, soprattutto nei pazienti di maggiore età. La scelta dell’agente anestetico deve essere rivolta ai farmaci per via endovenosa, in quanto tutti gli agenti volatili alogenati sono correlati al potenziale rischio di ipertermia maligna. Anche gli agenti miorilassanti depolarizzanti, come la succinilcolina, sono del tutto controindicati per le possibili reazioni avverse mortali.
L’assistenza respiratoria è cruciale in ogni fascia di età, e deve essere effettuata da personale esperto durante l’induzione, il mantenimento e il ricupero delle procedure di sedazione o anestesia generale; i rischi di fallimento dell’estubazione, di atelettasie polmonari post-operatorie o polmoniti sono elevati, soprattutto nelle fasi più avanzate della malattia. A questo scopo è opportuna una attenta valutazione preliminare della funzionalità, in particolare del picco-tosse, della capacità vitale forzata (FVC) e della massima capacità espiratoria (MEP): in caso di valori di picco tosse inferiori a 270 l/min oppure di MEP inferiore a 60 cm H2O (valori per pazienti oltre 15 anni) è necessario applicare nelle fasi pre- e post-operatorie le tecniche di assistenza alla tosse (attraverso apparecchio in-exsufflator); in caso di FVC inferiore al 50% del valore predittivo è consigliabile effettuare un training per la ventilazione non-invasiva (NIV) pre- e post-operatoria, mentre questa diventa necessaria se la FVC è inferiore al 30% (5).
Accessi in Pronto Soccorso
Il personale sanitario che opera in Pronto Soccorso non è sempre consapevole dei potenziali rischi di complicazioni specifici per la DMD e delle strategie di trattamento.
E’ necessario che tutte le Strutture di Emergenza e Accettazione siano informate sugli specifici protocolli o che siano in grado di contattare i Centri di riferimento presso cui i pazienti vengono seguiti quando devono trattare una persona con DMD.
Inoltre, in considerazione dell’aumentata aspettativa di vita e dell’atteso miglioramento della qualità della vita, deve essere attentamente discusso l’atteggiamento di astensione dalle cure avanzate nelle situazioni acute.
Quando un paziente accede per un qualsiasi motivo a una struttura di Emergenza, devono essere sempre monitorizzati lo stato respiratorio (rischio di scompenso respiratorio acuto) e cardiaco (rischio di aritmie improvvise); si deve inoltre considerare la ridotta risposta allo stress per infezioni in chi assume steroidi, utilizzare con cautela l’ossigeno senza ventilazione di supporto, e i sedativi centrali con azione depressiva sulla respirazione.
Il piano assistenziale globale
Come già osservato nel Documento sul Piano Assistenziale per la SLA prodotto dalla Consulta (allegato XX), secondo il Piano Sanitario Nazionale (PSN) è prevista la promozione di una rete integrata di servizi sanitari e sociali per l’assistenza ai malati cronici attraverso il miglioramento e la diversificazione delle strutture sanitarie.
Attualmente alla complessità dei bisogni e dei percorsi assistenziali delle persone con distrofia muscolare, come per tutte le altre numerose malattie neuromuscolari a carattere cronico progressivo, vengono date risposte molto differenti e ancora del tutto inadeguate sul territorio nazionale, come rilevato dal recente Censimento sulle Strutture Diagnostiche e Assistenziali afferenti all’Associazione Italiana di Miologia.
La problematicità e l’elevata intensità assistenziale richiesta da queste patologie deriva dalla estrema variabilità di coinvolgimento clinico, con forme che si manifestano già alla nascita o nei primi mesi di vita, altre in età infantile e altre ancora in età adulta con progressione variabilmente invalidante.
L’instabilità clinica, la necessità di una assistenza continuativa diversificata nelle varie fasce di età, il passaggio dell’assistenza dall’età evolutiva all’età adulta, la possibilità di ottenere farmaci ed ausili con le facilitazioni legate alla legislazione vigente ed il supporto alle famiglie costituiscono i nodi cruciali del piano assistenziale dei singoli pazienti.
Soprattutto per le forme più gravemente invalidanti (esempio, la DMD dalla terza decade in poi), il domicilio rappresenta sicuramente il luogo di elezione per l’assistenza per la gran parte della durata della malattia.
Alla luce di queste considerazioni e al fine di dare attuazione al PSN, nonché di uniformare su tutto il territorio nazionale l’approccio e la cura dei Pazienti affetti da Distrofia muscolare o malattie affini, le Regioni e le Province autonome possono predisporre progetti finalizzati a realizzare o potenziare percorsi assistenziali ambulatoriali e soprattutto domiciliari che consentano una presa in carico globale della persona con distrofia muscolare e dei suoi familiari.
Tali progetti o percorsi devono essere caratterizzati da una regia unitaria e da una attenzione effettiva a combinare standard di qualità e personalizzazione degli interventi.
All’atto della diagnosi, il CdR analizza il complesso delle funzionalità e i bisogni assistenziali, riconducendo la condizione del paziente ad uno degli stadi della malattia che verranno definiti successivamente. Predispone, quindi, una proposta di P.A.I. (Piano Assistenziale Individuale) che trasmette alla ASL di appartenenza del paziente. Si provvede inoltre alla programmazione degli interventi periodici per il follow up clinico. Preso atto della situazione clinica, deve essere precocemente attivata l’Unità di Valutazione Multidimensionale (UVM) (medica, infermieristica, fisioterapica e sociale) del territorio/ASL e il Medico di Medicina Generale (MMG) della Persona affetta da DMD per una corretta e tempestiva presa in carico del paziente da parte del territorio.
Compiti specifici dell’UVM sono:
- La formulazione del PAI anche su indicazione dei CdR;
- la facilitazione dei percorsi di accesso ai diversi punti della rete assistenziale di volta in volta coinvolti e a presidi, protesi ed ausili; per quest’ultimo aspetto si ritiene utile la creazione di Portali on line che possano mettere in diretta relazione CdR, UVM, ASL (ufficio protesi)
- l’interfaccia più semplice, agile e meno burocratica possibile tra la persona con DMD e i suoi familiari e gli uffici della Pubblica Amministrazione;
- il raccordo tra CdR e Medico di Medicina Generale.
L’UVM deve promuovere l’integrazione tra ospedale, territorio, servizi e figure professionali e promuovere risposte più efficaci per i bisogni dei pazienti, ed è composto come già indicato nell’Allegato per la SLA.
Il PAI sarà costituito da un documento scritto e sottoscritto dalle parti interessate (Persona con distrofia muscolare o genitori/tutori per i minorenni, familiari e figure professionali coinvolte nell’assistenza) e deve prevedere i seguenti elementi:
- dati identificativi del Paziente
- esito della valutazione multidimensionale con esplicitazione dei bisogni assistenziali
- definizione degli obiettivi di assistenza e delle azioni da intraprendere
- cronoprogramma degli interventi
- elenco dei servizi attivati e attribuzione delle responsabilità per gli specifici segmenti assistenziali
- indicatori per il monitoraggio e la valutazione dell’assistenza.
Il Distretto, attraverso il servizio di Assistenza Domiciliare Integrata (ADI), coinvolge il MMG del soggetto, informa i familiari sui servizi territoriali forniti con specifica “carta dei servizi”, identifica il case-manager (infermiere) di ogni soggetto, forma i familiari e il care-giver (o care-manager)
Inoltre il Distretto fornisce ausili e sussidi indispensabili ritenuti dall’UVM. La valutazione deve essere ripetuta inizialmente almeno ogni anno, poi con frequenza semestrale, oppure in occasione di eventi particolari, quali aggravamento delle condizioni cliniche, rientro da ricovero ospedalieri, non solo al fine di aggiornare il PAI ma anche di permettere un follow-up specifico e personalizzato con raccolta di dati gestiti, ove possibile, attraverso programmi informatizzati.
Assistenza domiciliare
Per quanto attiene specificamente agli interventi al domicilio sulla persona con DMD in età adulta, la ASL deve essere in grado di assicurare le seguenti figure professionali:
- MMG;
- neurologo
- fisiatra; fisioterapista motorio e respiratorio
- terapista occupazionale
- anestesista/pneumologo
- cardiologo
- nutrizionista
- psicologo.
In casi specifici può essere necessario l’intervento di un ortopedico, di un gastroenterologo o di un foniatra/logopedista.
Le attività delle suddette figure professionali che operano al domicilio del Paziente devono essere permanentemente in stretta correlazione con il CdR e al quale sono affidati le ospedalizzazioni per la gestione della fase acuta.
La ospedalizzazione delle Persone con DMD va ridotta al minimo indispensabile, individuando preventivamente all’interno del percorso assistenziale completo le fasi nelle quali è appropriato e indispensabile il ricovero ordinario, garantendo la gestione adeguata di tutte le altre a domicilio o in luoghi residenziali appropriati.
I pazienti possono avere necessità di ricovero ospedaliero nelle seguenti condizioni:
- problemi acuti non gestibili a domicilio (polmoniti con instabilità degli scambi gassosi; sepsi severa; scompensi metabolici acuti; scompenso cardiaco; addome acuto; malnutrizione)
- eventuali accessi in DH (con trasporto secondario organizzato dal care manager del distretto sanitario) per verifica dell’adattamento a ventilazione meccanica; sostituzioni di sondino PEG o cannula tracheostomica; esami diagnostici complessi (es., polisonnografia)
- adattamento alla ventilazione meccanica non invasiva non eseguibile domiciliarmente (in casi complessi)
- indicazione a tracheostomia e adattamento a ventilazione meccanica per via invasiva oppure indicazione a PEG
E' necessario ribadire che nelle varie fasi della malattia l'esperienza e la collaborazione del MMG è fondamentale per far sì che l'assistenza domiciliare sia prontamente adeguata al mutare delle condizioni cliniche. Il MMG riveste un ruolo cardine nell’assistenza domiciliare della Persona affetta da DMD soprattutto in età adulta, effettuando la valutazione preliminare di tutti i casi bisognevoli di un intervento in ADI e attivando il sistema di valutazione sistematica delle necessità, attraverso l’UVM. Inoltre l’interazione tra MMG e equipe multidisciplinare dei CdR e dell’ADI consentirà la creazione di una sinergia fondamentale per la continuità assistenziale nel percorso ospedale-territorio.
All’interno di ciascun Distretto dovrà essere altresì creata la funzione di Punto Unico di Accesso (PUA), nel quale avverrà la valutazione di primo livello, una sorta di triage del bisogno ad opera di figure professionali
specificatamente formate a questo compito.
Si ritiene indispensabile, infine, la creazione di servizi di reperibilità telefonica H24, gestiti dai CdR o dalle strutture territoriali, per garantire l’assistenza adeguata in caso di emergenze-urgenze.
Valutazione della richiesta assistenziale
Al fine di personalizzare gli interventi domiciliari si ritiene utile identificare il grado di compromissione funzionale dei paziente affetti da DMD tenendo in considerazione come principale riferimento la capacità di deambulare e l’indicazione all’assistenza ventilatoria. La perdita di queste funzioni avviene in un range di età relativamente ristretto (perdita della deambulazione tra i 9 e i 12 anni, ricorso alla ventilazione assistita in media tra i 15 e i 20 anni) e modifica la richiesta assistenziale del paziente.
Possono quindi essere identificate tre fasi funzionali cui fare riferimento per la stadiazione della malattia:
- STADIO A – paziente deambulante, richiesta assistenziale moderata
- STADIO B – paziente non deambulante, richiesta assistenziale intermedia
- STADIO C – paziente non deambulante con necessità di assistenza respiratoria
La richiesta di assistenza deve tenere conto delle esigenze che variano molto nelle fasi della malattia e della relativa richiesta di diverse figure assistenziali. Per quanto riguarda l’assistenza domiciliare, è necessaria per gli stadi B e C, e deve essere sempre disegnata individualmente secondo la situazione clinica del paziente.
Attualmente non sono disponibili valutazioni precise sui costi economici dell’assistenza domiciliare per i pazienti DMD; in linea generale per lo stadio C si possono prevedere costi analoghi a quanto indicato nel documento per la SLA., ma devono anche essere tenute in conto le variabili regionali.
Appare pertanto opportuno uno studio particolareggiato che prenda in esame le eventuali differenze legislative ed amministrative tra le varie Regioni cosi’ da uniformare il piu’ possibile, secondo criteri di razionalita’ e di attenzione verso le problematiche dei pazienti, l’offerta assistenziale.
Per quanto riguarda il personale non sanitario, tale assistenza andrà erogata proporzionalmente all’autonomia residua e alla presenza di assistenti familiari. Tali assistenti domiciliari (Case Manager) devono essere formati e operare in gruppo ristretto (in nuclei composti dagli stessi operatori per famiglia), avvicendandosi nell’assistenza in modo da creare “familiarità” con il paziente e con il suo ambiente di vita quotidiano. Considerando in particolare i pazienti con le necessità assistenziali più avanzate, come per la ventilazione meccanica invasiva, si ritiene indispensabile garantire la presenza di tali figure in un numero sufficiente di ore nella giornata per di alleviare il carico che grava sui familiari, spesso motivo di scadimento della qualità di vita, problematiche finanziare (necessità di ridurre le ore lavorative o talvolta necessità di rinunciare all’attività lavorativa.
Come già richiesto per i pazienti con SLA, è necessaria l’istituzione di Corsi di formazione per assistenti familiari per pazienti affetti da DMD. I corsi dovranno essere organizzati dai CdR in collaborazione con la Funzione Distrettuale di care management. Le Asl inoltre dovranno provvedere insieme agli organi regionali al riconoscimento giuridico della certificazione delle competenze acquisite.
Nell’ambito dell’assistenza domiciliare di pazienti in ventilazione assistita si ritiene utile l’attivazione di programmi di Telemedicina che garantirebbero uno stretto monitoraggio del paziente e la riduzione di accessi ospedalieri superflui riducendo la spesa economica sanitaria.
Strutture di semiresidenzialità e residenzialità
Come già in precedenza considerato, nel quadro di un percorso terapeutico-assistenziale è fondamentale prevedere trattamenti “a bassa intensità di cure e ad elevata intensità assistenziale e riabilitativa, in grado di garantire risposte ad esigenze diverse da quelle assicurate dalle strutture per acuti o al domicilio”. Nelle situazioni di grave disabilità o di mancanza di un ambiente familiare idoneo, la necessità di poter accedere a tali strutture diventa essenziale. Strutture di residenzialità temporanea o permanente, di “media medicalizzazione” rappresentano in queste situazioni la garanzia della continuità assistenziale.
Bibliografia
- Hoffman EP, Brown RH Jr, Kunkel LM. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell 1987; 51: 919–28.
- Jeppesen J, Green A, Steffensen BF, Rahbek J. The Duchenne muscular dystrophy population in Denmark, 1977–2001: prevalence, incidence and survival in relation to the introduction of ventilator use. Neuromuscul Disord 2003; 13: 804–12.
- Muntoni F, Torelli S, Ferlini A. Dystrophin and mutations: one gene, several proteins, multiple phenotypes. Lancet Neurol 2003; 2: 731–40.
- Bushby K, Finkel R, Birnkrant DJ, et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. Lancet Neurol 2009; published online Nov 30. DOI:10.1016/S1474-4422(09)70271-6.
- Bushby K, Finkel R, Birnkrant DJ, et al. Diagnosis and management of Duchenne muscular dystrophy, part 2: implementation of multidisciplinary care. Lancet Neurol 2009; published online Nov 30, DOI:10.1016/S1474 4422(09)70272-8.
- Beenakker EA, Maurits NM, Fock JM, et al. Functional ability and muscle force in healthy children and ambulant Duchenne muscular dystrophy patients. Eur J Paediatr Neurol 2005; 9: 387–93.
- Mazzone ES, Messina S, Vasco et al. Reliability of the North Star Ambulatory Assessment in a multicentric setting. Neuromuscul Disord 2009; 19:458-61
- Angelini C. The role of corticosteroids in muscular dystrophy: a critical appraisal. Muscle Nerve 2007; 36: 424–35.
- Bushby K, Griggs R, MSG/ENMC FOR DMD trial study group. 145th ENMC International Workshop: planning for an international trial of steroid dosage regimes in DMD (FOR DMD), 22–24th October 2006, Naarden, The Netherlands. Neuromuscul Disord 2007; 17: 423–28.
- Vignos PJ, Wagner MB, Karlinchak B, Katirji B. Evaluation of a program for long-term treatment of Duchenne muscular dystrophy. Experience at the University Hospitals of Cleveland. J Bone Joint Surg Am 1996; 78: 1844–52.
- Main M, Mercuri E, Haliloglu G, et al. Serial casting of the ankles in Duchenne muscular dystrophy: can it be an alternative to surgery?. Neuromuscul Disord 2007; 17:227-30.
- Pellegrini N, Guillon B, Prigent H, et al. Optimization of power wheelchair control for patients with severe Duchenne muscular dystrophy. Neuromuscul Disord 2004; 14: 297–300
- Forst J, Forst R. Lower limb surgery in Duchenne muscular dystrophy. Neuromuscul Disord 1999; 9: 176–81.
- Kinali M, Main M, Eliahoo et al. Predictive factors for the development of scoliosis in Duchenne muscular dystrophy. Eur J Paediatr Neurol 2007; 11:160-6.
- Birnkrant DJ. The American College of Chest Physicians consensus statement on the respiratory and related management of patients with Duchenne muscular dystrophy undergoing anesthesia or sedation. Pediatrics 2009; 123 Suppl 4:S242-4
- Bach JR, Ishikawa Y, Kim H. Prevention of pulmonary morbidity for patients with Duchenne muscular dystrophy. Chest 1997;112:1024– 1028.
- ATS Consensus Statement Respiratory Care of the Patient with Duchenne Muscular Dystrophy Am J Respir Crit Care Med 2004;170:456-65.
- Racca F,. Del Sorbo L,. Mongini T, et al. Respiratory management of acute respiratory failure in neuromuscular diseases. Minerva Anestesiol, in press
- American Academy of Pediatrics Section on Cardiology and Cardiac Surgery. Cardiovascular health supervision for individuals affected by Duchenne or Becker muscular dystrophy. Pediatrics 2005; 116: 1569–73.
- Bushby K, Muntoni F, Bourke JP. 107th ENMC International Workshop: the management of cardiac involvement in muscular dystrophy and myotonic dystrophy. 7th–9th June 2002, Naarden, the Netherlands. Neuromuscul Disord 2003; 13: 166–72.
- Poysky J, Behavior in DMD Study Group. Behavior patterns in Duchenne muscular dystrophy: report on the Parent Project Muscular Dystrophy behavior workshop 8–9 of December 2006, Philadelphia, USA. Neuromuscul Disord 2007; 17: 986–94.
- 22. Anderson JL, Head SI, Rae C, Morley JW. Brain function in Duchenne muscular dystrophy. Brain 2002; 125: 4–13.
- Hendriksen JG, Poysky JT, Schrans DG, Schouten EG, Aldenkamp AP, Vles JS. Psychosocial adjustment in males with Duchenne muscular dystrophy: psychometric properties and clinical utility of a parent-report questionnaire. J Pediatr Psychol 2009; 34: 69–78.


 AIM è aperta a tutti i professionisti che
AIM è aperta a tutti i professionisti che